¿Qué establece la ley de Boyle?
Tabla de contenidos
- ¿Qué establece la ley de Boyle?
- ¿Cuáles son las variables más importantes en la ley de Boyle?
- ¿Cuál es la variable dependiente en la ley de Boyle?
- ¿Que se mantiene constante en la ley de Charles?
- ¿Qué establece la ley general de los gases?
- ¿Qué variables relaciona la ley de Charles?
- ¿Cuál es la variable independiente el volumen o la presión?
- ¿Cuántas variables dependientes pueden haber?
- ¿En qué consiste la Ley de Boyle?
- ¿Qué es el experimento de Boyle?
- ¿Cómo se utiliza la Ley de Boyle en los automóviles?
- ¿Cuáles son las leyes de los gases ideales?
¿Qué establece la ley de Boyle?
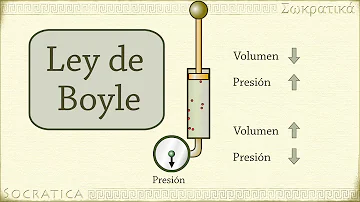
Ley de Boyle Establece que, a temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce, es decir si el volumen aumenta, la presión disminuye, y si la presión aumenta el volumen disminuye.
¿Cuáles son las variables más importantes en la ley de Boyle?
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. El volumen es inversamente proporcional a la presión: Si la presión aumenta, el volumen disminuye. Si la presión disminuye, el volumen aumenta.
¿Cuál es la variable dependiente en la ley de Boyle?
Experimento de Boyle El volumen se modifica empujando el émbolo móvil que cierra el recipiente (variable independiente) y, para cada uno de esos valores, la presión varía (variable dependiente).
¿Que se mantiene constante en la ley de Charles?
La ley de Charles es una de las leyes de los gases. ... En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye.
¿Qué establece la ley general de los gases?
La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que: ... La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
¿Qué variables relaciona la ley de Charles?
La ley de Charles y Gay-Lussac, frecuentemente llamada ley de Charles o ley de Gay-Lussac, es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa.
¿Cuál es la variable independiente el volumen o la presión?
Recordar que la independiente es la que manipula el investigador en este caso es el volumen y la dependiente es el efecto de la variable independiente que sería la presión.
¿Cuántas variables dependientes pueden haber?
En cualquier experimento puede haber más de dos variables dependientes.
¿En qué consiste la Ley de Boyle?
- En qué consiste la ley de Boyle En el año 1662 Robert Boyle, descubrió que la presión que era aplicada a un gas era inversamente proporcional a su volumen a temperatura y numero de moles constante. En otras palabras que si se aumenta del doble la presión ejercida sobre el gas, este mismo gas se comprimía reduciendo su volumen a la mitad.
¿Qué es el experimento de Boyle?
- Experimento de Boyle. Esta teoría explicaba que los átomos y moléculas, en el estado gaseoso, se comportan como centros puntuales de masa que sólo en el rango de las altas presiones y bajas temperaturas son afectadas por las fuerzas atractivas.
¿Cómo se utiliza la Ley de Boyle en los automóviles?
- Los motores a gasolina, gas o diésel también utilizan la ley de Boyle en el proceso de la combustión interna, ya que en un primer tiempo determinado ingresa el aire al cilindro con volumen y presión, y en un segundo tiempo, se disminuye el volumen al aumentar la presión de este. El sistema de airbag que poseen los automóviles, ...
¿Cuáles son las leyes de los gases ideales?
- Las tres primeras leyes pueden ser generalizadas en la ley de los gases ideales . Esta teoría explicaba que los átomos y moléculas, en el estado gaseoso, se comportan como centros puntuales de masa que sólo en el rango de las altas presiones y bajas temperaturas son afectadas por las fuerzas atractivas.















